FDA aprueba medicamento que combate rara enfermedad
Cuando los médicos le dijeron a Katrina Barry que tenía una afección rara y grave llamada hipertensión arterial pulmonar o HAP, le advirtieron que no buscara información en Internet.
Vamos, pensó; ¿querían que una joven que se dirigía a la escuela de posgrado, que había sobrevivido a un vuelo transatlántico mientras tenía un ataque al corazón y ahora una cirugía a corazón abierto, no buscara la condición que seguía intentando matarla?
Esperándola en internet había información inquietante. La HAP afecta a aproximadamente de 500 a 1.000 estadounidenses cada año, a menudo mujeres entre las edades de 30 y 60 años, según la Asociación Estadounidense del Pulmón.
Barry, que tenía 25 años en ese momento, descubrió en su lectura que tenía de dos a cinco años de vida, según la gravedad de su condición en ese momento.
Luego, su equipo médico le ofreció una posible tabla de salvación: Un medicamento experimental único en su tipo llamado sotatercept que atrapa un factor de crecimiento que se produce en exceso en personas con HAP, cambiando potencialmente la biología subyacente de la enfermedad.
Se inscribió en un estudio para probar el medicamento, que se administra cada tres semanas por inyección bajo la piel.
Comenzó el tratamiento al amanecer de la pandemia de covid-19, en marzo de 2020. Barry dijo que usaba diligentemente una mascarilla N95 y dos capas de ropa y se lavaba después de cada viaje al hospital para sus inyecciones para evitar contraer covid en el camino.
“Tuve que ir al hospital porque me estaba muriendo si no recibía este medicamento”, dijo. “Esta era la única oportunidad que tenía de sobrevivir”.
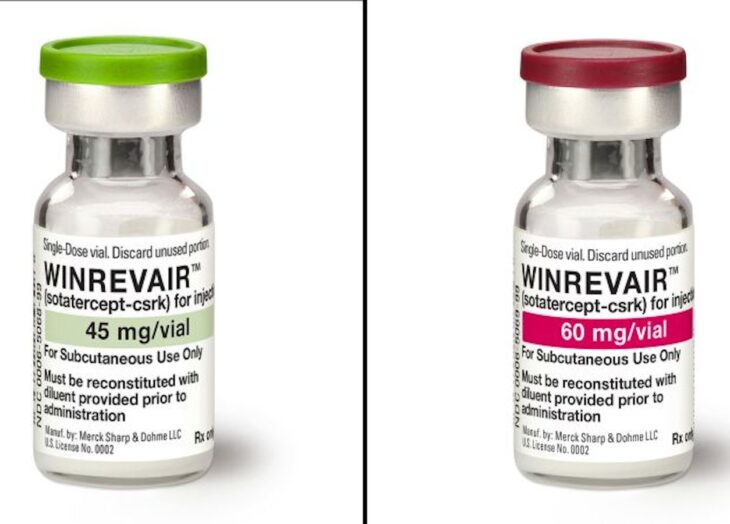
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó el medicamento que Barry ha tomado durante cuatro años, un medicamento al que atribuye haberla mantenido viva y haberle permitido reanudar muchas de las actividades que disfrutaba antes de su diagnóstico.
Merck, la empresa que fabrica el medicamento, dijo que se venderá bajo el nombre de marca Winrevair.
Barry, ahora de 29 años, es consultora de pacientes para Merck, pero dijo que no ha recibido compensación por contar su historia.
Winrevair es un medicamento biológico diseñado para atrapar y retener proteínas llamadas activinas que se producen en exceso en las personas que tienen HAP.
Estas proteínas hacen que las paredes de los vasos sanguíneos de una persona sigan creciendo y engrosándose con el tiempo.
A medida que los vasos sanguíneos se estrechan, el corazón se ve obligado a trabajar más para bombear sangre a los pulmones. Este estrés eventualmente daña el corazón, causando que falle.
Sin tratamiento, las personas con HAP suelen vivir unos dos o tres años después de su diagnóstico. El tratamiento con una combinación de medicamentos que dilatan o relajan los vasos sanguíneos puede mejorar esta perspectiva, pero no son una cura.
“Este medicamento tiene un mecanismo de acción muy diferente, y puede reequilibrar realmente parte del crecimiento que ocurre en los arteriolos pulmonares muy pequeños donde comienza la enfermedad”, dijo la Dra. Vallerie McLaughlin, cardióloga de la Universidad de Michigan que ayudó a estudiar sotatercept.
“Eso puede atacar la enfermedad desde un ángulo diferente y permitir lo que llamamos remodelación inversa”, dijo, lo que significa que los pacientes podrían mejorar con el tiempo mientras toman el medicamento.
Winrevair es el primer tipo nuevo de medicamento que surge para pacientes con HAP en mucho tiempo, dijo el Dr. Panagis Galiatsatos, especialista en medicina pulmonar y de cuidados críticos en el Centro Médico Bayview de Johns Hopkins y portavoz de la Asociación Estadounidense del Pulmón.
Estudio
En un estudio que incluyó a 323 personas que tomaron sotatercept o un placebo durante seis meses, aquellos que recibieron el medicamento pudieron caminar 34 metros, aproximadamente media cuadra de la ciudad, más lejos en seis minutos de lo que podían antes de comenzar el tratamiento, mientras que las personas en el grupo placebo pudieron caminar solo alrededor de 1 metro más de lo que podían cuando comenzaron el estudio.
Ambos grupos también estaban tomando los medicamentos estándar para la condición, que ayudan a relajar los vasos sanguíneos para mejorar el flujo sanguíneo.
Al final del estudio, nueve participantes, o aproximadamente 5 %, en el grupo de sotatercept habían muerto o su enfermedad había empeorado, mientras que 42 pacientes, o aproximadamente 26 %, en el grupo que tomaba un placebo habían muerto o empeorado.
La FDA estuvo dispuesta a actuar rápidamente para aprobar el medicamento porque la enfermedad, dijo Galiatsatos, es una “bomba de tiempo” para quienes no pueden esperar estudios más largos.
Ten la información al instante en tu celular. Únete al grupo de Diario Primicia en WhatsApp a través del siguiente link: https://chat.whatsapp.com/KnTn2mbuRdQBnU8na18Mod
También estamos en Telegram como @DiarioPrimicia, únete aquí: https://t.me/diarioprimicia