EEUU también autoriza pastilla de Merck contra el covid-19
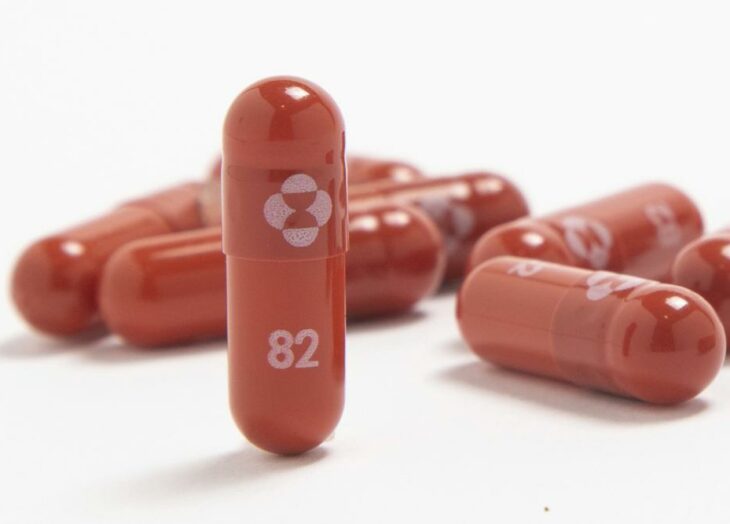
Las autoridades estadounidenses de salud autorizaron el jueves una segunda píldora contra el covid-19, una medicina de la farmacéutica Merck que puede tomarse en casa, lo cual ofrece otro medicamento fácil de usar para combatir la creciente ola de infecciones por la variante ómicron.
La autorización de la Administración de Alimentos y Medicamentos (FDA) al medicamento antiviral molnupiravir de Merck se produce un día después de que la misma agencia diera el visto bueno a una píldora de su rival Pfizer. Es probable que esa píldora se convierta en el tratamiento de primera elección contra el virus, gracias a sus mayores beneficios y a sus efectos secundarios más leves.
Como resultado, se espera que la píldora de Merck tenga un papel menor contra la pandemia de lo que se pronosticó hace apenas unas semanas. Su capacidad para prevenir los efectos severos del covid-19 es mucho menor de lo que se anunció inicialmente y la etiqueta del medicamento advertirá sobre riesgos graves de seguridad, incluso el potencial de defectos de nacimiento.
La FDA autorizó el medicamento de Merck para adultos con síntomas tempranos de covid-19 que enfrentan los mayores riesgos de hospitalización, incluidos los adultos mayores y aquellas personas con afecciones como obesidad y enfermedades cardíacas. Reino Unido fue el primer gobierno que autorizó la píldora, a principios de noviembre.
El medicamento de Merck llevará una advertencia contra su uso durante el embarazo. Las mujeres en edad fértil deben usar un método anticonceptivo durante el tratamiento y durante unos días después, mientras que los hombres deben usar un método anticonceptivo durante al menos tres meses después de su dosis final, dijo la FDA.
Las restricciones se esperaban después de que un panel asesor de la FDA apenas respaldara el medicamento el mes pasado, advirtiendo que el uso de molnupiravir tendría que adaptarse estrictamente a los pacientes que pueden beneficiarse más.
Ten la información al instante en tu celular. Únete al grupo de Diario Primicia en WhatsApp a través del siguiente link: https://chat.whatsapp.com/GGEskt8fXoU1z5i6W4V6bv
También estamos en Telegram como @DiarioPrimicia, únete aquí: https://t.me/diarioprimicia